Concurso Politec PE para Perito Criminal tem seu edital publicado com 213 vagas, e a banca AOCP foi contratada para o concurso, remuneração de cerca de 10 mil reais e um conteúdo extenso com 66 tópicos de 6 disciplinas diferentes (de acordo com o último edital de 2016 – CESPE). Ademais, as oportunidades desse próximo edital serão distribuídas entre os cargos de peritos criminais (77), médicos legistas (60), agentes de medicina legal (76).
No nosso artigo anterior (Politec PE: Como o estudo de 53% do edital pode garantir sua aprovação) demonstramos como é possível como é possível cobrir 90% das questões da prova com menos de 60% do conteúdo do edital de perito criminal (Química) do Concurso Politec PE. Dessa forma, quem sedimentar o conhecimento dos 35 assuntos mais relevantes entre os 66 totais, atingindo, por exemplo, 80% de acerto, deve garantir nota superior a 70 pontos dos 100 totais o que muito provavelmente levará o candidato para correção da prova discursiva com grandes chances de aprovação.
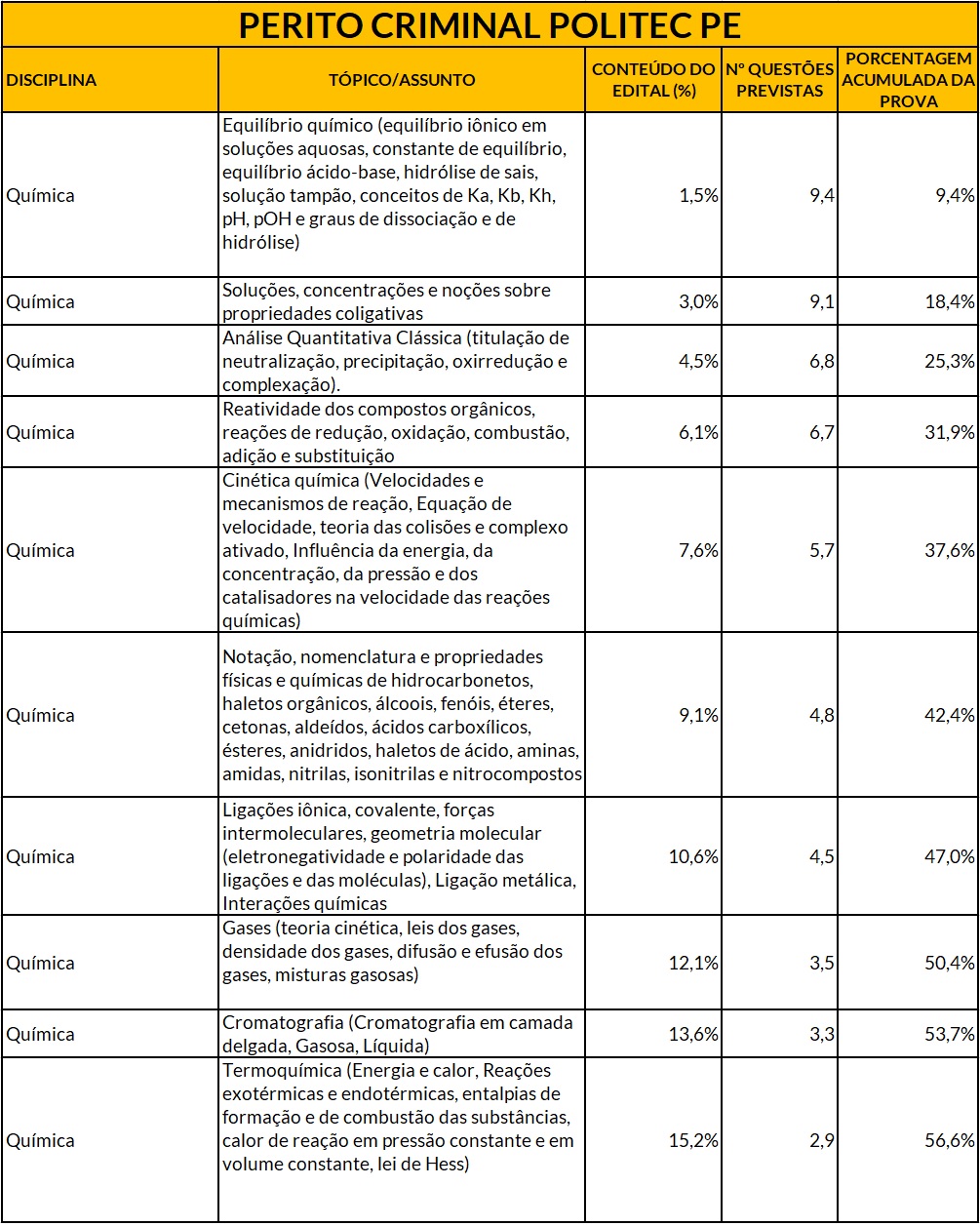
Portanto, neste artigo, iremos te passar dicas e orientações de como estudar os 10 assuntos mais relevantes para a prova de Perito Criminal Químico do Concurso Politec PE. Estes assuntos prioritários estão na tabela abaixo.
Tabela 1 – 10 assuntos mais importantes para Perito Criminal Químico do Concurso Politec PE
Dicas de Estudo
Então vamos lá para as principais dicas e orientações de cada um dos 10 assuntos prioritários:
1 – Equilíbrio Químico
Este assunto é muito amplo e complexo. Entretanto, é importante que o aluno concentre os estudos nos seguintes aspectos: princípio de Le Châtelier e sentido de deslocamento para cada variável alterada (concentração de produtos, concentração de reagentes, temperatura e pressão). Além disso, conheça o conceito de equilíbrio químico e de reação em equilíbrio (velocidades das reações direta e inversa são iguais, concentrações dos reagentes e produtos são constantes). Ademais, domine a Lei da ação das massas; conceito, interpretação e cálculo das principais constantes de equilíbrio; interpretação dos valores de constantes de equilíbrio (k=1, k<1, k<<1, k>1, k>>1). Por fim, entenda o efeito do íon comum; conceito de grau de ionização (α), sobretudo para ácidos e bases; Lei da diluição de Ostwald; características das soluções tampão; conceito e aplicação de capacidade de tamponamento (capacidade máxima em pH=pKa); Equação de Henderson-Hasselbalch (viabiliza a determinação do pH).
2 – Soluções
Tópico largamente cobrado em concursos da área de química. É fundamental que você estude a definição e os tipos de dispersões (solução verdadeira, solução coloidal e suspensão); o conceito de coeficiente de solubilidade. Além disso, saiba realizar o cálculo de concentração em diferentes unidades e tipos (concentração comum, título em massa, título em volume, molaridade, molalidade, fração molar e normalidade). Ademais, estude o cálculo de concentração inicial e final em diluições e em misturas de soluções de mesmo soluto. Por fim, estude a definição das propriedades coligativas e como elas afetam nosso cotidiano (ebulioscopia, tonoscopia, crioscopia, osmose).
3 – Análise Quantitativa Clássica – Volumetria
Dentro da análise volumétrica (ou Volumetria), temos como principais pontos a serem estudados: noções gerais dos conceitos envolvidos no experimento (titulante, titulado, ponto de viragem, ponto de equivalência, erro da titulação, indicador, padrão primário, padrão secundário). Além disso, saiba os detalhes práticos sobre a utilização da bureta; classificações das titulações. Por fim, saiba o detalhamento dos seguintes tipos de titulação – ácido-base (neutralização); por precipitação (destaque para métodos argentométricos); de complexação (destaque para utilização do EDTA); por oxirredução (principais métodos).
4 – Reações Orgânicas
Apesar deste conteúdo ser extenso, é importante focar nos seguintes aspectos: o significado e características de substrato, reagente, radical livre, nucleófilos e eletrófilos. Conheça as características das reações e diferenças entre os tipos de reações (Reação de Adição/Síntese, Reação de Eliminação, Reação de Substituição e Reação de Oxirredução. Por fim, conheça os principais exemplos de cada reação (esterificação, combustão, oxidação, redução); e os fatores que influenciam no andamento da reação.
5 – Cinética Química
É um conteúdo relativamente tranquilo, mas é super importante que você compreenda: o cálculo da velocidade da reação. Saiba determinar a ordem de reação; o conceito e fórmula do tempo de meia vida. Ademais, conheça a equação de Arrhenius, os principais fatores que afetam a velocidade de uma reação química (estado físico dos reagentes, superfície de contato, temperatura, catalisador, concentração dos reagentes). Por fim, estude a teoria das colisões; montagem da lei de velocidade; e os mecanismos de uma reação.
6 – Funções Orgânicas
Tópico que exige uma boa memorização por parte dos alunos para: identificar as principais funções orgânicas a partir do seu grupo funcional. Conheça as funções hidrocarboneto, álcool, fenol, éter, éster, ácido carboxílico, aldeído, cetona, anidrido, amina, amida, nitrila, isonitrila, nitrocomposto). Ademais, saiba montar a nomenclatura de cada uma das funções orgânicas (radicais+prefixo+infixo+sufixo). Por fim, domine as principais propriedades dos compostos orgânicos (polaridade forças intermoleculares, pontos de ebulição e fusão, solubilidade em água, densidade, reatividade).
7 – Ligações Químicas
Conteúdo basilar da área de química cobrado em concursos de diferentes níveis (médio, técnico, superior). Para se dar bem nesse tópico você precisa de saber as diferenças entre cada tipo de ligação química (covalente, iônica, metálica). Associe a diferença de eletronegatividade ao tipo de ligação. Além disso, estude as principais propriedades dos compostos covalentes, moleculares, iônicos e metálicos; tipos de interações intermoleculares (dipolo induzido, dipolo permanente, ligação de hidrogênio) e associá-las as propriedades da substância. Reconheça a polaridade das substâncias; principais geometrias moleculares; Teoria da repulsão entre os pares de elétrons da camada de valência. Por fim, conheça a representação da estrutura de Lewis de diferentes moléculas, associar a fórmula RPECV à geometria molecular. Relacione solubilidade e polaridade das substâncias.
8 – Estudo dos Gases
Assunto cobrado nas disciplinas de química e física. Reconheça as variáveis de estado (pressão, temperatura, volume) e as principais transformações gasosas. Domine os gráficos e fórmulas da transformação isotérmica, isobárica e isovolumétrica. Além disso, conheça a equação dos gases ideais e como realizar cálculos com a mesma. Finalmente, entenda o fator de compressibilidade e a sua relação com os gases ideais e reais, e os parâmetros da equação de van der Waals.
9 – Cromatografia
Assunto importante na área pericial e de pesquisa, no qual você precisa de saber o conceito básico e princípios da cromatografia, fases móvel e estacionária. Entenda a classificação dos métodos cromatográficos em relação ao tipo de suporte, fase e natureza da fase móvel. Ademais, compreenda os principais mecanismos de separação (adsorção, absorção, troca iônica, exclusão molecular, afinidade). Reconheça os principais tipos de cromatografia (delgada, em coluna, líquida, fasosa) e as vantagens/desvantagens de cada uma. Além disso, estude os conceitos de eluente, eluato, eluição, tempo de retenção, fator de retenção, resoluçã, eficiência, equação de Van Deemter. Por fim, conheça as principais funções de cada parte dos equipamentos de cromatografia gasosa e líquida (injetores, tipos de colunas, detectores), e as vantagens e limitações de cada uma e tipos de substâncias que podem ser analisadas em cada.
10 – Termoquímica
Conteúdo muito importante na área de química e largamente cobrado em diversas provas. Entenda os conceitos de temperatura, calor, equilíbrio térmico, e a aplicação da termoquímica em nosso dia a dia. Ademais compreenda os conceitos de energia interna, sistema, vizinhança, e conheça as principais funções de estado energia interna (U), entropia (S), entalpia (H). Compreenda a Lei Zero e a 1, 2 e 3 Leis da Termodinâmica. Ademais, entenda a fórmula da primeira lei (Princípio da conservação de energia) e como calcular a capacidade calorífica em diferentes situações. Por fim, saiba diferenciar as reações/processos endotérmicos e exotérmicos, entenda os diferentes tipos de entalpia (de formação, ligação, etc) e as principais formas de calcular a entalpia (a partir da entalpia de formação, entalpia de ligação ou Lei de Hess).
Então é isso, espero que tenham gostado das dicas e orientações e que elas tenham sido bastante úteis para o estudo destes assuntos prioritários, pois eles podem representar um pouco mais da metade da sua prova (57 questões de 100),como pôde ser visto na Tabela.
Antes de finalizar gostaria de convidá-los para assistir essa live com todos os detalhes do último edital da POLITEC PE, etapas, requisitos, estatísticas da banca, estratégias de estudo e muito mais com o Prof. Manoel.
Ah! E lembro que o Prof Diego Souza também disponibilizou o artigo Concurso Politec PE: Edital cada vez mais próximo, com todas as informações deste concurso
Considerações Finais
Caso tenham gostado das dicas e orientações, saibam que os Roteiros de Estudo e Bizus da Científica Concursos possuem além destas orientações, estatísticas de relevância/importância do assunto por banca; por onde, como e o quê estudar; orientações sobre estudo e revisão; aspectos que você precisa dominar, e uma esquematização completa do conteúdo nas disciplinas de conhecimentos específicos.
Acreditamos que as dicas e orientações de como estudar os 10 assuntos mais relevantes para a prova de perito criminal químico do Concurso da POLITEC PE ajudarão bastante na sua preparação. Comente aqui embaixo o que achou deste artigo.
E, por último, lembro que já temos planos de Mentoria e Monitoria para Perito Criminal POLITEC PE (áreas de Química, Biologia, Física, Farmácia) e para Médico Legista PE.
Mentoria e Monitoria para Perito Criminal e Médico Legista POLITEC PE
Bons estudos!




